Évtizedes kutatás után ritka betegség okára derült fény
Írott nyelvükben az ékezetek értelemformáló fontossága - gondoljuk csak kor és a kór szavakra – egyértelmű, de az kevéssé ismert, hogy az élőlények genetikai információját rejtő nukleinsavakban léteznek ilyen „ékezetek”. Az örökítőanyagban tárolt minden, a nukleotidsorrenden felüli információt (kémiai vagy térszerkezeti változásokat) epigenetikai módosításoknak nevezik. Ezek a módosítások létfontosságúak minden kicsit is bonyolultabb többsejtű élőlény, így az ember számára is, hiszen nélkülük nem lehetnének különböző típusú sejtjeink úgy, hogy genetikai kódjuk egyébként azonos.
Az elmúlt évtizedekben leginkább a genetikai információ hosszú távú tárolását végző DNS epigenetikai módosításai álltak a figyelem és a kutatások középpontjában, de az utóbbi években egyre több eredmény bizonyította, hogy másik kulcsfontosságú nukleinsavunkat,
az RNS-t érintő „epitranszkriptomikus” módosulatoknak is fontos szerepük van a sejtek megfelelő működésében.
Az MTA-SE Lendület Nephrogenetikai Kutatócsoport vezetésével a Semmelweis Egyetem, az Eötvös Loránd Tudományegyetem, valamint a University College London kutatói a napokban megjelent tanulmányukban azt mutatták ki, hogy milyen súlyos következményekkel járhat, ha a sejtek egyik „RNS-ékezetét” készítő enzim meghibásodik a szervezetben.
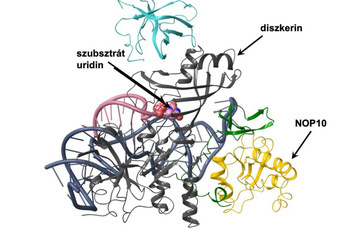
A kutatás kiindulópontjában a Semmelweis Egyetem I. Sz. Gyermekgyógyászati Klinikán Szabó Attila professzor által gondozott, ismeretlen eredetű betegségben szenvedő család áll. Az elsősorban a fiúkat érintő vese-, szem-, fül- és bélérintettséggel járó kórkép eredetének feltérképezését a Tory Kálmán által vezetett MTA-SE Lendület Nephrogenetikai Kutatócsoport kezdte meg. Első lépésként a párizsi Imagine Intézettel együttműködve azonosították a felelős régiót az X-kromoszómán, majd a Kölni Egyetemen szekvenálva a régiót, megtalálták a kóroki variánst a diszkerin enzimet kódoló DKC1 génben. A diszkerin az egyike azoknak az enzimeknek, amelyek az RNS-molekulák „ékezeteiért” felelnek, és amely nélkül számos pozícióban nem jön létre a pszeudouridinnek nevezett módosulás.
A Lendület-kutatócsoport rámutatott, hogy a kóros mutáció három generációval korábban, a betegséggel együtt alakult ki a családban. A DKC1 gén szerepe váratlan volt, mert variánsait korábban egy teljesen más, a kromoszómát lezáró telomerek rövidülésével járó betegségben azonosították. A génhez társuló új betegség szokatlan eredetére a fehérjeszerkezeti kutatások derítettek fényt. A diszkerin egy nagyobb molekuláris komplex tagjaként fejti ki a hatását, ahol a különböző fehérjék koordinált együttműködése szükséges ahhoz, hogy a megfelelő RNS-módosítások bekövetkezhessenek.
A Karancsiné Menyhárd Dóra, az MTA-ELTE Fehérjemodellező Kutatócsoport tudományos főmunkatársa által végzett szerkezeti modellezés kimutatta, hogy
az új DKC1-mutáció hatására károsodik a diszkerin kulcsfontosságú katalitikus régiója, és megváltozik a diszkerin kapcsolata egyik partnerével, a NOP10 fehérjével.
Számításait Balogh Eszter, az MTA-SE Lendület Nephrogenetikai Kutatócsoport és Schay Gusztáv, az SE Biofizikai és Sugárbiológiai Intézet kutatói is igazolták a két fehérje kapcsolatának nyomásperturbációs fluoreszcencia-spektroszkópia vizsgálatával.
A végső bizonyítékot, hogy az újonnan leírt betegséget az enzim károsodása, nem pedig a telomerrövidülés okozza, egy állatmodell szolgáltatta. Varga Máté, az ELTE TTK Genetikai Tanszék adjunktusának csoportja több olyan zebrahalvonalat hozott létre a CRISPR/Cas9 genomszerkesztő rendszer használatával, amely az állatok saját diszkerin enzimjét kódoló génben hordozott mutációkat. A mutáns állatok nagyon hasonló szervi érintettséget mutattak, mint a betegek, és vizsgálatukkal ki lehetett mutatni, hogy a betegség számos tünete mögött a sejtosztódás zavara áll. Ez a fehérjeszintézisért felelős riboszómák hibás működésével hozható összefüggésbe, amit a pszeudouridinek hiánya okoz a riboszómákat is létrehozó RNS-molekulákban.
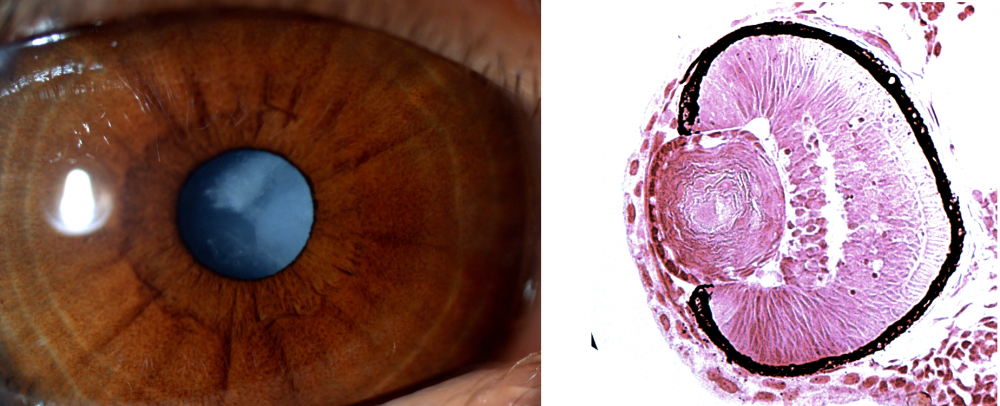 Bal oldalon az egyik beteg szeme, melyen jól megfigyelhető a szürkehályog, jobbra pedig az egyik mutáns zebrahallárva szemének metszete – itt jól látszik, hogy a szemlencse fibrózus szerkezetű
Bal oldalon az egyik beteg szeme, melyen jól megfigyelhető a szürkehályog, jobbra pedig az egyik mutáns zebrahallárva szemének metszete – itt jól látszik, hogy a szemlencse fibrózus szerkezetű
(Forrás: MTA-SE Lendület Nephrogenetikai Kutatócsoport)
A több mint egy évtizeden át tartó munka tartogatott még egy meglepetést: két évvel ezelőtt egy londoni kutatócsoport a NOP10 fehérjében is azonosított egy ugyanezen tünetegyüttest okozó variánst, melynek a diszkerin-NOP10 interakcióra gyakorolt hatása megegyezik a diszkerinben talált mutációéval. A közös közlemény így végül angol, francia, kanadai és német kutatókkal való kollaboráció eredménye lett, melyet az Egyesült Államok Tudományos Akadémiájának hivatalos folyóirata, a Proceedings of the National Academy of Sciences lapjain publikáltak.
Forrás: elte.hu
Borítókép: MTA-SE Lendület Nephrogenetikai Kutatócsoport

