A tumorsejtek képesek előnyükre fordítani a DNS-ben tárolt információt

Csabai István, az ELTE Komplex Rendszerek Fizikája Tanszék egyetemi tanára kutatócsoportjával a komplex genetikai és epigenetikai adatok kiértékelését végezte. Kiemelkedően fontos volt Ribli Dezső PhD-hallgató munkája, aki a kópiaszám-változás és kromoszómatörések pozíciójának meghatározását, valamint az epigenetikai mérések elemzését végezte. A kutatócsoport a nemrég alakult ELTE Biotechnológia FIEK keretében más hazai és nemzetközi kollaborációkban is végez hasonló tudományos „big data”-elemzéseket. Csabai professzor a társ-elsőszerzővel, Spisák Sándorral, a Harvard Egyetem Dana Farber Rákkutató Intézetének kutatójával együtt évek óta foglalkozik molekuláris genetikai kérdések vizsgálatával. A közlemény szerzői között további magyar kutatók (Tisza Viktória, Szállási Zoltán, Solymosi Norbert) is szerepelnek, akik a Csabai-csoporttal évek óta együttműködnek.
Az emberi genom DNS-szekvenciájának (3,2 milliárd bázispár) csupán kevesebb mint 2%-a tartalmazza a sejtek építőköveit, a fehérjéket kódoló géneket. A fennmaradó – korábban jelentéktelennek gondolt – 98%, úgynevezett nem-kódoló rész funkciója jóval kevésbé ismert, de egyre több kutatás bizonyítja, hogy fontos szerepet játszik többek között a gének ki-bekapcsolódásának vezérlésében, és a sejten belüli háromdimenziós térszerkezet kialakításában. E folyamatok pontos mikéntjének megértése még várat magára, de egyre inkább intenzíven kutatott terület. Annyi mára már biztos, hogy
központi szerepük van az epigenetikai mozzanatoknak
(DNS-metiláció, hisztonfehérje-módosulások, transzkripciós faktorok), amelyek különböző „jelzésekkel” ellátva a DNS-t, befolyásolják annak működését, aktivitását és térszerkezetét.
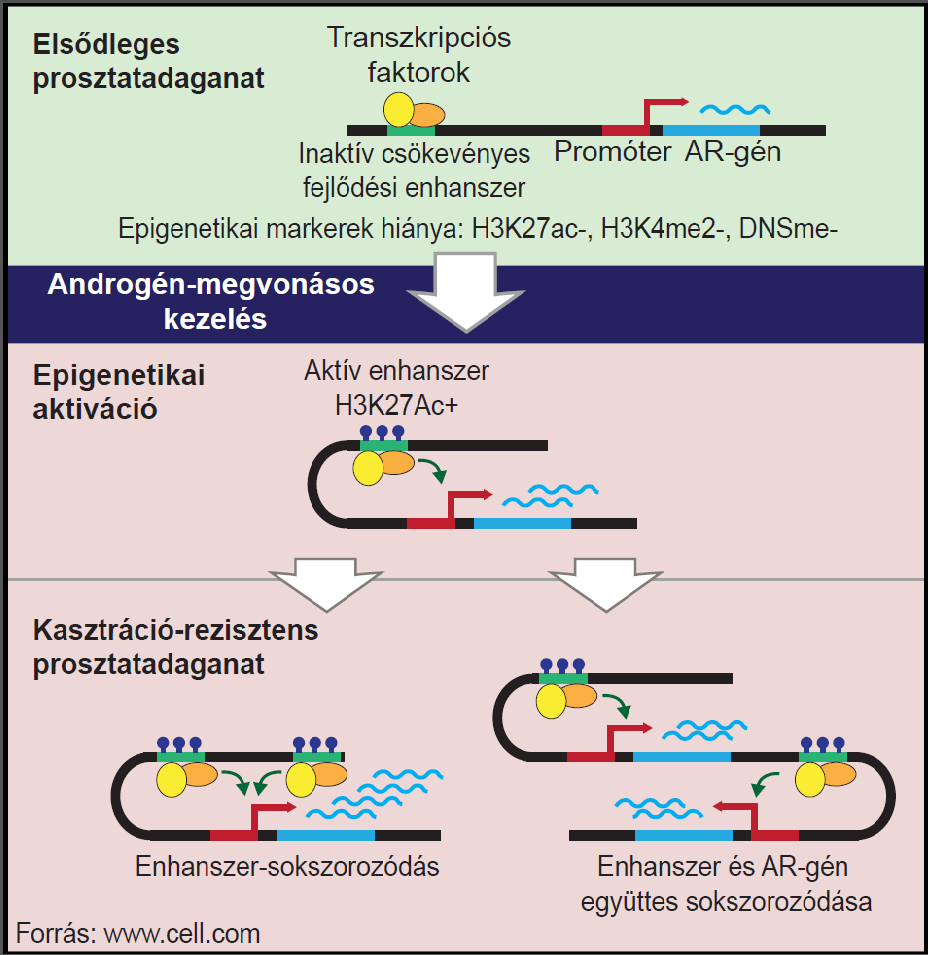
A kutatások kiinduló kérdése az volt, hogy a csupán az USA-ban évente több tízezer férfi halálát okozó áttétes prosztatarákok több mint háromnegyede miért válik idővel ellenállóvá (a kezdetben hatásos) úgynevezett androgén-megvonásos kezelésekkel szemben. Azt tudták, hogy a jelenségért az X kromoszómán található androgén receptor (AR) génjének egyfajta túlműködése felelős, amely a tumorsejtek gyógyszeres kezelésre (hormonterápiára) adott válaszaként jön létre. De eddig úgy gondolták, hogy a magasabb AR-fehérjeszint egyszerűen az AR-gén megduplázódásának (kópiaszám-változás) köszönhető. A most megjelent tanulmányban azonban
a kutatók egy nélkülözhetetlen szabályozó régió – enhanszer elem – felfedezéséről tudósítanak,
amelynek irányító szerepe van a folyamatban, az AR-géntől több mint félmillió bázispárra, a nem-kódoló DNS-ben.
A kutatást vezető Matthew Freedman a TV-készülékek távirányítójához hasonlítja az enhanszer elemet, amely meglehetősen távolról képes ki- és bekapcsolni az AR-gént. A metasztatikus tumorok ezt a számukra előnyös folyamatot, vagyis „a távirányító bekapcsolását” tanulják meg és alkalmazzák sikeresen növekedésük során. Az egészséges sejtek erre nem képesek. A kutatás eredményei alapján nem egy hagyományos értelemben vett génsokszorozódásról van szó. Először ugyanis az enhanszernek aktívvá kell válnia, ami csak a tumorsejtekben lehetséges. Ennek következtében fokozódik az androgénreceptor-fehérje termelése, majd a fehérjeszint még tovább növekszik az enhanszer önmagában való vagy az AR génnel együtt történő sokszorozódásával. A megfigyelések szerint az AR-gén önmagában sosem sokszorozódik.
Az enhanszer létezése és jelentősége idáig rejtve maradt. Nem is csoda, hiszen a rendelkezésre álló korlátozott vizsgálati módszerek miatt eddig szinte csak a génekre és azok hibáira fókuszált a kutatói közösség. A friss tanulmány viszont azt tárta fel, hogy a szabályozó régió nem közvetlenül a gén mellett helyezkedik el, hanem a DNS-nek egy relatíve távoli részén, 650 000 bázispárnyira az AR-gén elejétől. Csabai István szerint a következő években a technológia további fejlődésével, a DNS fizikai tulajdonságainak feltárásával még számos hasonló meglepetésre számíthatunk.
Becslések szerint a humán genomban közel egy millió enhanszer pozíció létezik (ezzel szemben a gének száma kb. 20 000), amelyek eltérően működhetnek különböző sejttípusokban.
A mostanáig alkalmazott vizsgálati eszközök nem tették lehetővé az enhanszerek pontos azonosítását
és funkcionális jellemzését, azonban a tanulmányban alkalmazott ChIP-Seq (kromatin immunprecipitációt követő szekvenálás) és DNS-DNS-interakciós vizsgálatok lehetőséget adtak ennek a fontos AR-szabályozó régiónak a pontos behatárolására előrehaladott prosztatadaganatos klinikai mintákban. A CRISPR/Cas9-genom- és epigenom szerkesztő metodika (CRISPR screen) és az új generációs szevenálás (NGS) pedig az enhanszer funkcionális jellemzését tette lehetővé szövettenyésztéses modell kísérletekben. Az új módszerek rengeteg adatot generálnak, amelyek kiértékelése új kihívás és csak multidiszciplináris kollaborációban lehetséges.
A szerzők bebizonyították, hogy az enhanszer régió sokszorozása önmagában is megemeli az AR szintet. Továbbá arra is fény derült, hogy az aktiválódott enhanszer nélkülözhetetlenné válik a sejt életben maradásához. Ugyanis, ha CRISPR/Cas9 génsebészeti eszközökkel az enhanszer régiót a megfelelő pozícióban megsértették vagy teljesen eltávolították a rákos sejtekből, az a rákos sejtek pusztulásához vezetett.
Spisák Sándor kiemelte, ez jó példa arra, hogy lássuk,
a tumorsejtek képesek előnyükre fordítani a DNS-ben és a DNS-en tárolt információt.
A tanulmányban bemutatott enhanszeren keresztül olyan epigenetikai program újraaktiválása valósul meg áttétes tumorokban, mely csak az egyedfejlődés során kizárólag a prosztata sejtjeinek kialakulásakor aktivizálódik, majd normális esetben élethosszon keresztül kikapcsolva marad. A pontos mechanizmusról – ki- és bekapcsoló molekulákról – jelenleg csak részleges információval rendelkezünk. Ennek megfejtése – ami egyben a kutatások következő lépcsőfoka a tervek szerint – új alapokra helyezheti a gyógyszercélpont-kutatást – tette hozzá a kutató. Solymosi Norbert szerint mivel az azonosított DNS-szakasz több állatfajban nem vagy csak részlegesen található meg (pl. egér, patkány), felvethető, hogy ezek a fajok csak korlátozottan használhatók modellállatként az előrehaladott prosztatadaganatok kutatásában.
A párhuzamosan megjelent másik közlemény szerzőinek vérmintákból is sikerült kimutatni a tumorból kijutott DNS-darabokat, és azok közt a fent bemutatott módon megtalált AR-enhanszer kópiaszám változását. Ez alátámasztja a felfedezést, és felveti annak lehetőségét, hogy akár diagnosztikai biomarkerként használjuk a friss kutatási eredményeket.