A fehérjék jégbe fagyott titka
Ha részleteiben meg akarjuk érteni, hogy hogyan működnek a fehérjék és más makromolekulák a szöveteinkben és sejtjeinkben, akkor szükségünk van térszerkezetüknek és kölcsönhatásuknak atomi szintű hálózatának a feltérképezésére. A biológiai minták ilyen nagy felbontású vizsgálatára a krio-elektronmikroszkópia nemrégiben vált alkalmassá és az utóbbi néhány évben nagyon nagy hatékonyságúnak bizonyult a biomakromolekulák feltérképezése területén. A vizsgálathoz a fehérjemolekulákat -137°C alatti hőmérsékleten vizsgálják, ahol téralkatuk akár atomi felbontással is meghatározható speciális elektron-mikroszkópos felvételek segítségével.
E fagyasztott világban ott van az élővilág lenyomata: a fehérje téralkata, belső mozgása és kölcsönhatásai felderíthetők.
A transzmissziós krio-elektronmikroszkópia módszerét - melyet Nobel-díjjal ismertek el 2017-ben - használják kutatóink az NKFIH Top 50 kutatóhelye között szereplő ELTE Fehérjemodellező Kutatócsoportja és Szerkezeti Kémiai és Biológiai Laboratóriumában a nagyobb fehérjék szerkezetkutatásában. A módszer új lehetőségeket nyitott meg a nagy fehérjék és makromolekula-komplexek szerkezetkutatásában.
A vitrifikálás, vagyis gyors lefagyasztás megőrzi és rögzíti a makromolekulák természetes téralkatát, ideális esetben sokféle orientációban. Az elektronnyaláb kölcsönhatásba lép a vizsgált mintával és a létrejövő képeket feldolgozva a molekulára jellemző 3D-alakzatok csoportokba rendezhetők, amelyekből a képalkotás történik.
A krio-EM alkalmas nagyméretű molekuláris struktúrák - akár vírusok vagy riboszóma, proteaszóma és más fehérje-multimerek és komplexek - 3D-szerkezeteinek és molekuláris kölcsönhatásainak feltérképezésére, de akár hatóanyagok tervezésének támogatására is. Korábban az ELTE kutatói meghatározták az AAP (acilaminoacil-peptidáz) nevű fehérje térszerkezetét, amely enzim emlősökben előforduló formájának térszerkezete teljesen ismeretlen volt.
Az AAP fehérje a szervezet egyik legfontosabb hibajavító rendszerét támogatja, segítve a hibásan feltekeredett és sérült fehérjék lebontását. Ha az AAP fehérje sérül a szervezetben, az közismerten káros átalakulásokhoz vezethet.
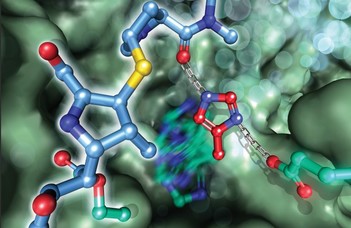
 Az ábra azt mutatja, hogy a meropenem nevű antibiotikum molekula hogyan kötődik az AAP fehérjéhez, amelynek következtében az AAP nem tudja többé betölteni a katalizátor szerepét.
Az ábra azt mutatja, hogy a meropenem nevű antibiotikum molekula hogyan kötődik az AAP fehérjéhez, amelynek következtében az AAP nem tudja többé betölteni a katalizátor szerepét.
Perczel András, az ELTE Szerves Kémia Tanszék professzora és kutatótársai - Kiss-Szemán Anna, Jákli Imre, Harmat Veronika és Karancsiné Menyhárd Dóra mostani munkájuk során igazolták, hogy egy gyakran használt penicillinszerű antibiotikum – amellett, hogy hatékonyan harcol a baktériumok ellen - gátolja az emberi szervezet AAP enzimének működését, ezáltal a szervezetben felhalmozódhatnak a káros fehérjék. A meropenem antibiotikum véglegesen blokkolja az AAP fehérje működését a szervezetben. Az ELTE kutatói felfedezték, hogy
a meropenem penicillin-származék, antibiotikumként a jótékony hatása mellett olyan fehérjét is blokkol az emberi szervezetben, amely létfontosságú.
Az ELTE kutatói elsőként térképezték fel ezt a gátlási folyamatot. Az általuk meghatározott szerkezet az AAP fehérje működésének jobb megértésében és a terápiában betöltött lehetséges új szerepek alapját képezhetik, valamint bepillantást engednek azokba a folyamatokba, amelyek révén az antibiotikumok mellékhatásokat okozhatnak az emberi fiziológiában.
 A Royal Society of Chemistry folyóirat címlapján az ELTE kutatói által feltérképezett emlős AAP fehérje meropenem antibiotikummal gátolt szerkezete látható.
A Royal Society of Chemistry folyóirat címlapján az ELTE kutatói által feltérképezett emlős AAP fehérje meropenem antibiotikummal gátolt szerkezete látható.
Eredményeiket a Royal Society of Chemistry (RSC) Chemical Science folyóiratában a címlapon közölték, valamint „Pick of the Week" megtisztelő címet és bekerült az újság éves „Hot Article Collection” válogatásába is.
Az első magyar krio-elektronmikroszkópos címlapsztori - Interjú Perczel Andrással.

