Szabados életet élő fehérjék nyomában
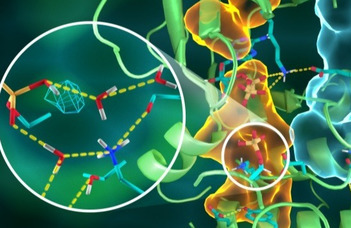
A promiszkuitás, azaz a szexuális partnerek váltogatása jól ismert biológiai fogalom. De létezik-e ez a jelenség a molekulák, a fehérjék világában? Természetesen abban az értelemben, hogy vannak-e a molekuláris partnereiket gyakran váltogató fehérjék? Erre a kérdésre a válasz igen. Nyitray László, a Biokémiai Tanszék professzorának munkacsoportja, együttműködésben Martinek Tamás, a Szegedi Tudományegyetem Orvosi Vegytani Intézetének „Lendület” pályázat nyertes kutatócsoportjával, a fehérje-fehérje kölcsönhatások körében járt utána a promiszkuitásnak.
Minél több fehérje-fehérje kapcsolat van egy élőlényben, annál komplexebb szerveződésű. Az élő rendszeren belül a fehérje-fehérje kölcsönhatások összessége, az ún. interaktom a molekuláris szintű komplexitás legfontosabb eleme. A fehérjék egymással (és más biomolekulákkal) kialakított fizikai kapcsolata az egyetlen kommunikációs eszköz, amivel a „sejtváros lakói”, a makromolekulák információt tudnak cserélni egymással.
Az interaktom az egy élőlény teljes genetikai állományára használt fogalom. Az elnevezés a genom mintájára született meg, hasonlóan a teljes fehérjekészleteket leíró proteom vagy a teljes mRNS állományra használt transzkriptom kifejezéssel együtt. Ezeket a kifejezéseket a ma születőfélben lévő, a rendszerbiológia részét képező „omika” tudományok használják.
A Nature lapcsalád Scientific Reports folyóiratában a közelmúltban megjelent közlemény egy korábban megkezdett kutatás folytatása. Ennek során egy evolúciós értelemben fiatal, csak a gerinces állatokban előforduló, S100 fehérjecsalád 20 tagját kezdték el tanulmányozni. Ezek a fehérjék a sejtekben kitüntetett szabályozó szerepet betöltő kalciumionokat kötik meg, ennek hatására pedig más fehérjékkel képesek kölcsönhatásba lépni, és ezáltal nagyszámú fiziológiás, és sajnos patológiás folyamatban játszanak szerepe. Ez utóbbi mindig az S100 fehérjék túlzott termelődésével függ össze. A sokféle betegségben, például
áttéteket képző tumorok, neurodegeneratív és gyulladásos betegség kialakulásában betöltött szerepük miatt az S100 fehérjecsalád komoly diagnosztikai és terápiás jelentőséggel bír.
A korábbi munkában a kutatók feltárták a fehérjecsalád fajlagosságát, s rájöttek, hogy a család egyik része promiszkuus, azaz többféle partnerfehérjével is kapcsolatot létesít, míg a család másik fele „monogám”, egy vagy néhány partnerfehérjéhez kötődik csak, vagy egyáltalán nincs ismert partnere. Az S100 család kölcsönhatási hálózata jelenleg még eléggé hézagosan ismert, ami a további kutatások korlátjává vált.
Ezen a ponton jött létre szakmai kapcsolat a Szegedi Tudományegyetem munkatársával, Martinek Tamással, aki kutatócsoportjával a világon az elsők között állított elő úgynevezett „foldamer” könyvtárakat. A foldamerek olyan, a fehérje-fehérje kölcsönhatásokban résztvevő szerkezeti elemeket utánzó viszonylag kisméretű szintetikus oligomerek, ún. biomimetikumok, melyek a gyógyszerfejlesztés ígéretes eszközei, főleg olyan esetekben, amikor a célfehérjéhez szerves kismolekulával nem lehet fajlagos kötést elérni. A foldemerek használhatóságát, miszerint képesek a célfehérjéket funkció alapján megkülönböztetni, a Martinek-csoport, többek-között a Nyitray-csoporttal együttműködve a nagy presztizsű kémiai folyóiratban, a Journal of Chemical Biology-ban közölték. Ezt a publikációt az újság a 2020-as Chemical Science HOT Article Collection közé emelte.
A kutatók a most közölt munkában egy hattagú, két aminosav oldalláncot „mimikáló” foldemerekből álló molekulakönyvtár segítségével
az S100 fehérjecsalád összes tagjának a kötőfelszínét le tudták tapogatni.
Ráadásul úgy, hogy az elméletileg létező majdnem összes, bár minimális méretű (2 aminosav) foldamerrel végeztek el 256x16, azaz több mint 5000 kötési mérést!

A közleményben használt foldamerek szerkezete.
A nagyszámú mérésre a világon elsők között alkalmaztak egy olyan ún. „holdup” módszert, amelyet eredetileg a francia együttműködő partnerük, Gilles Travé és munkatársai dolgoztak ki. Az adatok validálására pedig a Nyitray-csoport által a korábbi vizsgálatokhoz kidolgozott fluoreszcens polarizációs módszerrel történt. Ráadásul a „nagy áteresztőképességű” módszer lehetővé tette azt is, hogy egy egyszerű algoritmust használva minden egyes S100 fehérjére kiszámoljanak egy „promiszkuitási értéket”. A közleményben ismertetett kísérletek oroszlánrészét Simon Márton, OTDK díjazott és kétszeres ÚNKP nyertes kémia mesterszakos hallgató (azóta a Semmelweis Egyetem doktorandusza) végezte.

Az S100 fehérjék (sorok) foldamerekhez (oszlopok) kötésének ún. hőtérképe. Minél sötétebb a cella, annál erősebb a „holdup” módszerrek mért kölcsönhatás.
Az eredmények részben kiegészítik, részben megerősítik a korábbi cikkben közölteket. Nevezetesen, hogy az S100 család körülbelül fele „szabados életet él”, egyértelműen nem válogat a partnerek (foldamerek) között, míg a másik fele csak egy-két partnerrel vagy eggyel sem létesít fizikai kapcsolatot.
A fenti eredményeket a jövőben elvégzendő, az S100 fehérjék patológiás szerepét megszüntetni kívánó gátlószer-fejlesztéseknél feltétlenül figyelembe kell venni, amennyiben hatékony és a legkevesebb mellékhatással rendelkező gyógyszert kívánnak előállítani.
 Nyitray László biológus a fehérjék szerkezete és funkciói közötti összefüggések feltárásán, valamint az S100-fehérje diagnosztikára alkalmas eljárásainak kifejlesztésén dolgozik. Korábban a motorfehérjék titkait kutatta, ma elsősorban a fehérjék közötti kölcsönhatásokat és a fehérjeszabályozás különböző módozatait tanulmányozza a biokémia, a sejtbiológia, a géntechnológia, a bioinformatika és a szerkezeti biológia változatos eszköztárával. Az Akadémiai Díjjal kitüntetett professzor csoportja korábban a kutatásokat forradalmasító módszert dolgozott ki a nehezen kristályosodó fehérjék atomi szintű szerkezetvizsgálatában. Fejlesztésük felhasználásával hosszabb távon olyan terápiás gyógyszerhatóanyagok is készülhetnek, amelyek csökkenthetik bizonyos tumorok áttétének kialakulását.
Nyitray László biológus a fehérjék szerkezete és funkciói közötti összefüggések feltárásán, valamint az S100-fehérje diagnosztikára alkalmas eljárásainak kifejlesztésén dolgozik. Korábban a motorfehérjék titkait kutatta, ma elsősorban a fehérjék közötti kölcsönhatásokat és a fehérjeszabályozás különböző módozatait tanulmányozza a biokémia, a sejtbiológia, a géntechnológia, a bioinformatika és a szerkezeti biológia változatos eszköztárával. Az Akadémiai Díjjal kitüntetett professzor csoportja korábban a kutatásokat forradalmasító módszert dolgozott ki a nehezen kristályosodó fehérjék atomi szintű szerkezetvizsgálatában. Fejlesztésük felhasználásával hosszabb távon olyan terápiás gyógyszerhatóanyagok is készülhetnek, amelyek csökkenthetik bizonyos tumorok áttétének kialakulását.A kutatómunkát az NKFIH egyéni kutatói pályázatai és a Fehérjetudomány és alkalmazásai nemzeti program támogatta.
Nyitray László és kutatócsoportjának korábbi eredményei:


