Az amiloid túl- vagy alulszabályozott képződése okozhatja az Alzheimer-kórt
Dr. Perczel András, az ELTE TTK Szerves Kémia Tanszék vezetője évek óta kutatja az aminosavak láncfüzéréből álló, rendkívül összetett térbeli szerkezetű, felépítésükben pedig molekuláris üzenetet hordozó fehérjéket. Számos cikk és könyv számolt be eddig is a kiváló ELTE-s kutatócsoport eredményeiről, most azonban áttörést jelentő új felfedezéseiket címlapon hozzák a legrangosabb kémiai szaklapok. Ezért a kutatót arról kérdeztük, ok vagy okozat a szokatlan fehérjeforma a kórkép kialakulásában, amely ellen gyógyszer egyenlőre nem kecsegtet? Mit tudtak az ELTE-n hozzátenni ehhez, a világszerte kutatott „hot topic”-hoz?
Ha jól tudjuk, akkor az amiloid struktúra a fehérjék egy új téralkata?
A molekuláknak és így a fehérjéknek is, - noha ezek az aszpirin, morfin, glükóz vagy más ismertebb kismolekuláknál sokkal nagyobb méretű természetes polimerek – van szerkezetük, megjelenésük perdöntő! Térszerkezetnek nevezi a szaknyelv a molekulák küllemét és alakját, ami - mint a hétköznap életben, úgy itt is - meghatározza a használhatóságot.
Ha minden nagyobb és kisebb tárgynak van térszerkezete, akkor mi szokatlan van az amiloidban?
A molekuláris evolúció 3-4 milliárd éve alatt a fehérjék folyamatosan alakultak és változtak, ám a mai tudásunk szerint ezalatt az idő alatt, a téralkatra nézve csupán csak 2 sikeres stratégia azonosítható. Minden fehérje egy lineáris polimer, amely lánc tartalmaz mind vizet szerető, mind víztaszító aminosavakat. Ez utóbbiak értelemszerűen „nehezen férnek meg” a vízzel, amely közeg ad otthont az élő rendszerek legtöbb molekulájának. Az egyik sikerre vezető stratégai, – a bölcs egymás mellett élés jegyében – az, hogy
a fehérjelánc úgy tekeredik fel gyorsan és kompakt módon, hogy a víztaszító aminosavakat a saját belsejébe temeti.
A fehérjeevolúció - a rejtegetés kényszere alatt - vizet át nem eresztő, úgynevezett globuláris téralkatok sokaságát eredményezte. A humán genom mintegy húszezer fehérjéjének téralkata, 70-85 %-ban globuláris. A másik stratégia mentén a fehérjeláncban lévő víztaszító (más szóval hidrofób) aminosavak ismétlődő mutációk során vagy kikoptak, vagy be sem épültek a láncba. A lecsökkent víztaszító aminosavak száma miatt ezeknek a fehérjéknek már nem kell feltekeredniük, nem kell a víz számára átjárhatatlan globuláris téralkatot létrehozniuk, hanem mint sikló a vízben, izegve-mozogva töltenek be fontos biológiai funkciókat. A fokozott belső mozgékonyságuk okán ezeket intrinsically dynamic protein-nek mondja az angol, s IDP-nek rövidíti. A minket felépítő, cirka 37 billió sejt mindegyikében sok-sok ezer fehérje található, melyek csupán kétfélék lehetnek: vagy globuláris fehérjék, vagy IDP-k.
 Perczel András szerves- és szerkezeti kémikus, egyetemi tanár, a Magyar Tudományos Akadémia rendes tagja, az MTA–ELTE Fehérje Modellező Kutatócsoport és az ELTE TTK Szerves Kémia Tanszék vezetője. Fő kutatási területe a biomolekulák szerkezetvizsgálata és a fehérjék NMR spektroszkópiája. 2011-ben a Bolyai János alkotói díj kitüntetettje. Legfontosabb tudományos eredményeit az alkalmazott spektroszkópia (CD, NMR, stb.), a kvantumkémia, a molekula modellezés és molekulaszintézis (szénhidrátok, glikopeptidek, fehérjék) területeken érte le. Figyelme fókuszában elsősorban a polipeptidek és fehérjék dinamikus térszerkezete és a biológiai hatású molekuláris hátterének feltérképezése áll, vizsgálataik kiterjednek az in vitro és in vivo molekuláris és nano-rendszerekre is. Összesen több mint 250 tudományos közlemény szerzője vagy társszerzője, amelyek elsősorban angol nyelven jelentek meg, ezekre több mint 4800 független hivatkozás érkezett.
Perczel András szerves- és szerkezeti kémikus, egyetemi tanár, a Magyar Tudományos Akadémia rendes tagja, az MTA–ELTE Fehérje Modellező Kutatócsoport és az ELTE TTK Szerves Kémia Tanszék vezetője. Fő kutatási területe a biomolekulák szerkezetvizsgálata és a fehérjék NMR spektroszkópiája. 2011-ben a Bolyai János alkotói díj kitüntetettje. Legfontosabb tudományos eredményeit az alkalmazott spektroszkópia (CD, NMR, stb.), a kvantumkémia, a molekula modellezés és molekulaszintézis (szénhidrátok, glikopeptidek, fehérjék) területeken érte le. Figyelme fókuszában elsősorban a polipeptidek és fehérjék dinamikus térszerkezete és a biológiai hatású molekuláris hátterének feltérképezése áll, vizsgálataik kiterjednek az in vitro és in vivo molekuláris és nano-rendszerekre is. Összesen több mint 250 tudományos közlemény szerzője vagy társszerzője, amelyek elsősorban angol nyelven jelentek meg, ezekre több mint 4800 független hivatkozás érkezett.Honnan tudták, hogy van egy harmadik típusú fehérje? A semmiből megjelent egyszer csak a tudás horizontján a fehérjék harmadik formája, az amiloid térszerkezet?
Igen! Ma még részben ismeretlen, sejten belüli változásokra visszavezethető okok miatt a szálszerűen kígyózó, globuláris fehérjék egy-egy rövidebb szegmense meglazul, majd ez a részlet más, vagy önmagához hasonló lánchoz simul és összetapadnak. Ahogy a folyón úszó farönkök idővel egymás mellé rendeződnek, majd illeszkednek és ezáltal tutajjá kapcsolhatók össze, talán ugyanígy képződik a fehérje 3. fajta téralkata: az amiloid szabályos nano-struktúrája. Szemre szép és tetszetős a molekuláris építészet e remekműve, s ahogy a felhőkarcolók szintről szintre épülnek felfelé, ugyanígy egy képzeletbeli zsaluzás segítségével illeszkednek össze és alkothatnak megbonthatatlan stabilitású amiloid filamentumot.

A baj csak az hogy ez a „szépséges” szerkezet, az önerősítő önrendeződés során egyre növekvő hosszúságú amiloid szállá áll össze. Idővel az amiloidok összetorlódnak és ahogy a jég zajláskor kilép a folyó medréből és torlaszokat épít, úgy nőnek és terjeszkednek az amiloid struktúrák egyre nagyobbra, majd aztán szétfeszítik sejtes környezetüket. A normál sejtekben a fehérje sűrűség nagy, ezért tudnak gyorsan növekedni egymáshoz tapadni az amiloidok. Idővel a normál celluláris működés megbomlik, a sejtes struktúra szétesik, a szövet a szerv pusztulásnak indul.
Ilyen módon veszti el az Alzheimeres beteg folyamatosan és visszavonhatatlanul egyre több idegsejtjét, ami miatt a személy kognitív és vegetatív képességei drámai romlásnak indulnak.
A szomorú mentális leépülés hátterében az amiloid plakkok számának növekedése és a neuronok abnormálisan felgyorsult pusztulása áll, noha jelenleg még nem bizonyított az, hogy ebben a láncolatban mi az ok és mi az okozat.
Mely fehérjék képesek erre a veszélyesnek tűnő határtalan növekedésre?
30-50 évvel ezelőtt azt hittük, hogy csak néhány fehérje van, amelyik vagy hibásan hasad, vagy természetes lebomlása közben egy-egy átmeneti terméke felgyülemlik, és ez okozza a bajt, az amiloidok megjelenését. Például az Amiloid Precursor Protein, röviden APP, hasadása során keletkezik az emberben az Aβ1-42 szálszerűen kígyózó rövidebb fehérjedarab, amelynek a neuronokban megnövekedett koncentrációja amiloidot képezhet és Alzheimer-kórt eredményezhet.
Ez a központi idegrendszeri betegség a demenciák kb. 60 %-ért felelős, amelyre jelenleg sajnos még semmilyen gyógymód sincs!
A 80 évnél idősebbek között nem ritka ez a betegség: kezelésükre csak USA-ban tavaly (2019) mintegy 290 milliárd dollárt költöttek. Az elmúlt évtizedek kutatásai során tucatnyi sikerrel kecsegtető gyógyszerjelölt vérzett el: egy sem jutott a fázis 3 klinikai vizsgálatokon túl! Tovább szaporodtak a rossz hírek, amikor megtalálták az alfa-Szinuklein nevű fehérjét, amelyből szintén képződhet amiloid, amely viszont a Parkinson-kór kialakulásért felelős. S jöttek idővel az újabb és újabb megfigyelések, s az amiloid képződéshez köthető betegségek száma egyre csak nőtt és nőtt. Ma azt gondoljuk, hogy a genom lényegében bármely fehérjéje képezhet akár végzetes amiloidot, bizonyos körülmények között feltekeredhet ebbe a 3. típusú fehérjetérszerkezetbe.
A vég kezdete volna ez?
A helyzet nem örömteli. Úgy tíz éve, elméleti megfontolások és alkalmazott kvantumkémia számításokkal bizonyítottuk azt a termodinamikai hipotézist, hogy bármely fehérje számára felvehető az amiloid térszerkezetet! Munkánkat akkor az amerikai kémiai társaság lapjában (JACS) közöltük, eredményünket azóta is hivatkozzák.
Az amiloid igazi fehérje-temető, a fehérjeképződés zsákutcája ez.
Az amiloid képződés során lényegében béta-redőzött rétegek téralkatok kapcsolódónak rendezett módon egymás mellé. Az egyre növekvő méretű amiloid nanostruktúrák egyre megbonthatatlanabbak, egyre erősebben tapadnak egymáshoz.
De β-redőzött téralkattal tele vannak az egészségesen működő globuláris fehérjék? Hogy lehetséges ez?
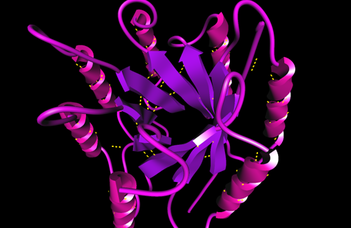
Valóban a fehérjék spirál-szerű, alfa-hélixnek nevezett térbeli alakzata mellett, a nyújtott alakzatú béta-redő a második legelterjedtebb és jól felismerhető forma a fehérjékben (lásd lila spirálok és magenta nyilak az alábbi ábrán). Ám ideális fiziológiás körülmények közepette ez a nyújtott téralkat szigorú „kontrol alatt van”, soha sincs „egyedül hagyva” éppen azért, hogy nehogy amiloid képződést kezdeményezzen.

Miben áll mostani munkájuk jelentősége?
Az elmúlt évtizedben százával jelentek meg olyan cikkek, amelyek egy-egy fehérje esetében amiloid képződésről számoltak be. Ám olyan munka, amelyik a sejtes körülmények szisztematikus feltérképezésének, a pH, a hőmérséklet, a fehérjekoncentráció stb. függvényében vizsgálja az amiloid képződés lehetőségét és tényét, vagy annak molekuláris mechanizmusát ma is ritka, mert nehéz.
Mi a II-es típusú cukorbetegség gyógyítása során használt fehérjegyógyszer, az Exenatid általunk fejlesztett variánsainak amiloid képződését térképeztük fel,
írtuk le munkánk általánosítható tapasztalatait. Ráadásul egy alkalmas spektroszkópiai módszert is fejlesztettünk a folyamat lépésenkénti monitorozása érdekében, olyat amely teljesen általános és bármely fehérje amiloidózisa során alkalmazható. Kiroptikai módszerünk széles körben használható és betekintést enged az amiloid téralkat kialakulásának a részleteibe is.

Az amiloid képződés tehát a fehérje feltekeredés hibája lenne? Olyan összetett patológiás folyamat, amely során inkább elveszett, vagy netán túlműködik a „kontrol”?
Nehéz erre a kérdésre általában válaszolni. Az összetapadó nyújtott térszerkezetű béta-szálak között - ahogy a molekuláris „épület” egyre nő - egyre több összetartó erő kontrollálja és alakítja ki a nanostruktúrát. Tehát mondhatjuk azt hogy ahogy növekszik az amiloid, úgy nő a kontrol. Ugyanakkor ma azt gondoljuk, hogy a normális fiziológiás működéshez képest valami megbomlott az amiloidózis során, valami elveszett, valami alulműködik (pl. egy enzim), s ezért a fehérjék működése hibás, a rendszer netán alulkontrollált.
Van remény az Alzheimer gyógyítása terén?
Csak 1992 és 2018 között, több mint 150 – később sikertelennek ítélt, korábban gyógyszerjelölt molekulát vizsgáltak és fejlesztettek ideig-óráig a gyógyszergyárak. A kudarc milliárd dolláros veszteségeket jelentett, amit csak a legnagyobb gyártók és forgalmazók tudtak túlélni. Még van azért néhány, talán 4-5 sikerrel kecsegtető molekula a tarsolyban. Remény persze mindig van.
Mi azt gondoljuk, hogy az áttörést éppen a polipeptid és fehérjekémia, éppen az amiloid képződés molekuláris miértjeinek és mikéntjeinek a jobb megértése hozhat.
Ezért kutatjuk évtizedek óta, minden kihívás ellenére, szakadatlan lelkesedéssel ezt a területet az ELTE-n mi is. A mostani eredményeinkkel - amelyek többek között a Chemistry nevű rangos folyóiratban jelentek meg - egyre közelebb kerülünk a neurodegeneratív betegségek molekuláris szintű megértéséhez és az öregkori elbutulás majdani gyógyításához.


