Hibatűrő szöveti hierarchiák új trükkjére derítettek fényt biofizikusaink
"Alapvetően arra vagyunk kíváncsiak, hogy megújuló szöveteink, amelyek rengeteg sejtet gyártanak le életünk során, hogyan tudnak védekezni a rák kialakulása ellen” – magyarázza Grajzel Dániel biofizikus doktorandusz, aki e témában OTDK 3. helyezést ért el. Az ELTE biofizikusai matematikai modellek segítségével próbálják feltárni, hogy pontosan milyen mechanizmusok alapján működhetnek a szöveteink.
Az új eredmények 2020. január 6-án jelentek meg a Proceedings of the National Academy of Sciences – PNAS folyóiratban (az Egyesült Államok Tudományos Akadémiájának hivatalos lapja), a világ második leghivatkozottabb tudományos folyóiratában.
A TÖBBSEJTŰSÉG ÁRA
Mintegy egymilliárd évvel ezelőtt az egysejtű élőlények mellett megjelentek az első soksejtűek. Az új élőlényeket felépítő, együttműködő és megújuló sejtek szövedéke minőségileg új szintet jelentett. Ára is volt a fejlődésnek, hiszen a
többsejtűek folyton osztódó sejtjeiben halmozottan jelentkeztek az örökítőanyag replikációs hibái, a káros mutációk pedig felhalmozódhattak.
Legveszélyeztetettebbek a „folyamatosan megújuló szöveteink” kényszerűen sok osztódáson áteső sejtjei (a bőr és a bél hámsejtjei vagy a vér megújuló sejtjei), hiszen náluk nagyobb az esély olyan, a többi egészséges sejttel szemben osztódási előnyt nyújtó mutációk kialakulására, amelyek a sejt utódainak túlszaporodásához, és rákos daganatok kialakulásához vezethetnek.
Megújuló szöveteink azonban évmilliók alatt kifejlesztettek több védekező mechanizmust.
Néhány éve már sikerült felismerni és leírni ezek közül kettőt, amelyekkel a „folyamatosan megújuló szövetek” a sejtek osztódásából származó mutációs terhelést képesek mérsékelni, sőt, az osztódási előnyt nyújtó, káros mutációk „kiseprését” is elvégzik.
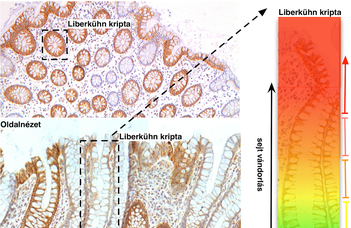
 A vékony- és vastagbélben találhatók az ún. Lieberkühn kripták, a nyálkahártya betüremkedés-szerű mirigyei. A Lieberkühn kripták a bél hámrétegét alkotó sejtek folyamatos utánpótlását biztosítják. A bélhámsejtek fokozatosan, egyre gyorsabban osztódó kompartmenteken keresztül vándorolnak a bélhám felszíne felé, ahonnan a bélüregbe lökődnek („kiseprés”), így a bélcső hámrétege folyamatosan megújul. Ez a szerveződés, amely lehetővé teszi a sejtszám erős regulációját, a kutatás eredményei szerint a káros mutációk hatékony eltávolítására is alkalmas. Forrás
A vékony- és vastagbélben találhatók az ún. Lieberkühn kripták, a nyálkahártya betüremkedés-szerű mirigyei. A Lieberkühn kripták a bél hámrétegét alkotó sejtek folyamatos utánpótlását biztosítják. A bélhámsejtek fokozatosan, egyre gyorsabban osztódó kompartmenteken keresztül vándorolnak a bélhám felszíne felé, ahonnan a bélüregbe lökődnek („kiseprés”), így a bélcső hámrétege folyamatosan megújul. Ez a szerveződés, amely lehetővé teszi a sejtszám erős regulációját, a kutatás eredményei szerint a káros mutációk hatékony eltávolítására is alkalmas. Forrás
OSZTÓDÁSI KÜSZÖBÉRTÉK
Grajzel Dániel új modellje a valódi szövetekben megfigyelhető sejtszámszabályozást is figyelembe veszi, amely a sejtek osztódási ütemét lassítja vagy gyorsítja, attól függően, hogy a kívántnál éppen több vagy kevesebb sejt van az adott szöveti kompartmentben. Az új eredmények frissen jelentek meg a Proceedings of the National Academy of Sciences – PNAS folyóiratban (az Egyesült Államok Tudományos Akadémiájának hivatalos lapja), a világ második leghivatkozottabb tudományos folyóiratában.
Grajzel és kollégái a statisztikus fizika elméleti eszköztárát felhasználva kimutatták, hogy e szabályozási mechanizmusban
létezik egy „küszöbérték”, amely alatt az osztódási előnyben lévő mutáns sejtek nem képesek a szövetben maradni
– ez a „kiseprés”. A potenciálisan magas osztódási előny ellenére a mutánsok a szöveti hierarchia utolsó szintjét elérve, a bélhám felszínén, osztódni képtelen sejtként hagyják el a szövetet.
A modellből adódó új felismerés, hogy a „küszöbérték” nagyságát elsősorban az befolyásolja, hogy mekkora a kompartment-méret, azaz hány azonos differenciáltságú sejt található az egy-egy őssejthez tartozó szöveti egységben. Minél kisebb a kompartment-méret, annál magasabb lesz a küszöb, annál nagyobb osztódási előnyre van szükség a szövetben maradáshoz.
Kis sejtszámú kompartmentek esetén viszont – hacsak az osztódási előny nem kellően nagy – a sejtben nincs elegendő idő a rák kialakuláshoz szükséges mutációk összegyűlésére.
Eredmények a gyakorlatban
A kutatócsoport új eredményei nem pusztán elméletiek. Konkrét, kísérletileg ellenőrizhető jóslatokat is tesznek: az osztódási előnyt nyújtó mutációk jelentős, a küszöbértéket meghaladó előnyt kellett, hogy nyújtsanak, egyébként nem maradhattak volna meg a szövetben. Mivel a modell alapvetően egészséges szövetek működését írja le, ennek az állításnak igaznak kell lennie mindazokra a mutációkra, amelyeket végül rákos daganatokban találunk, de ugyanúgy az egészséges szövetekben előforduló, osztódási előnyt nyújtó mutációkra is, amelyek egyelőre még nem vezettek daganat kialakulásához.
Az emberi vékony- és vastagbélben található ún. Lieberkühn kriptákban egy kompartment mérete nagyjából 100 sejt, így az elméleti számítások alapján az osztódási előnyre kapott 20%-os küszöbérték egyezik az eddigi kísérleti mérések eredményével. Egyéb szöveteknél még nem áll rendelkezésre elegendő mérés, de a legújabb DNS-szekvenálási adatok azt mutatják, hogy az egészséges szövetekben hosszabb távon fennmaradó mutációk meglepően nagymértékű osztódási előnyt biztosítanak. Ez – bár a mutáns sejt számára előnyös – a gazdaszervezet számára halálos veszélyt jelenthet!

Grajzel Dániel negyedik féléves fizika BSc hallgatóként csatlakozott az MTA-ELTE "Lendület" Evolúciós Genomika Kutatócsoport, mely a megújuló szövetek dinamikájával és a rák kialakulásával foglalkozik.
"Akkoriban fogalmam sem volt arról, hogy mit jelent igazából (bio)fizikusnak lenni, mit jelent az, ha valaki kutató. A közös munka során egyre jobban beletanultam a kutatásba, fokozatosan nőttek a feladatok és elvárások, velük párhuzamosan az eredmények is. Nagy élmény volt például MSc hallgatóként a természettudományi kari TDK-ra készített munkám eredményeiről előadást tartani egy USA-beli nemzetközi konferencián" - mondta Grajzel Dániel.
Az érdeklődő diákok legközelebb az ELTE TTK 2020. január 17-i Nyílt Napján találkozhatnak Grajzel Dániellel, feltehetik kérdéseiket erről a kutatásról, valamint a fizikus képzésről és az elhelyezkedési lehetőségekről.


